ДИОКСИНЫ И ЖИВЫЕ ОРГАНИЗМЫ
V.1. Взаимодействие с биологическими системами
V.1.1. Биоконцентрирование
Многие свойства диоксинов, в первую очередь их токсикологические особенности, связывают с высокой липофильностью и исключительной стабильностью в живых организмах и объектах окружающей среды [764].
Липофильная природа диоксинов способствует §кумуляции§ их в органической фазе биосферы и биоконцентрированию в живых организмах. В представителях фауны диоксины эффективно накапливаются главным образом в жировых тканях (примерно на 9/10 [765]). В больших количествах они накапливаются также в печени, коже, тимусе, кроветворных органах [765-768]. В жировой ткани и в крови их уровень коррелирует с содержанием липидов [213].
Биоконцентрирование осуществляется главным образом по пищевым цепям. Оно происходит также путем межфазных переходов из любых сред, в том числе из воздуха, воды и почв (даже в случае их ничтожного содержания в этих средах) [137,324]. Другими словами, большинство ПХДД и ПХДФ легко поглощается живыми организмами и через желудочно-кишечный тракт [4,769-771], и через кожные покровы [4,260,772]. Механизм их проникновения в клетки пока не очень ясен [773].
Предполагается, что коэффициент биоконцентрирования (КБК) непосредственно связан с коэффициентом распределения в системе октанол-вода (разд.II.2) простой зависимостью [774,775], например [775]:
lg КБК = 0,76 Кow — 0,23.
Экспериментальные значения КБК диоксинов III и IV в организме животного или в растениях оказались, однако, заметно ниже тех, что можно было ожидать [197], исходя только лишь из данных о коэффициентах распределения диоксинов в системе октанол-вода и растворимости их в воде. В организме рыб, в частности, значение КБК изменяется от 2000 до 6000 [776]. Это расхождение объясняется существенным влиянием биохимических особенностей аккумулирующих организмов на степень поглощения и удерживающую способность в отношении диоксинов. Кроме того, свойства чистых диоксинов существенно отличаются от свойств их реальных аддуктов с органическими веществами, принимающими участие в биопереносе [136,335,777].
V.1.2. Распределение в живых организмах. Выведение из организмов
Диоксины чрезвычайно стабильны в живых оргaнизмах, следствием чего является их длительное сохранение в биосфере.
Токсикокинетические исследования последних лет показали, что они очень медленно выводятся из живых организмов, а из организма человека практически не выводятся [143,778,779].
В частности, период полувыведения высокотоксичного диоксина 2,3,7,8-ТХДД из живых организмов составляет (в днях) [778-780]:
мышь, хомячок — 15
крыса — 30
морская свинка — от 30 до 94
обезьяна — 455
человек — 2120 (5-7 лет)
Высокохлорированные ПХДД имеют сопоставимое время полувыведения из организма человека — порядка 3-6 лет [781].
Для высокотоксичных ПХДФ период полувыведения из организма человека несколько меньше — от 1 до 3 лет [781-785]. Найдена явная зависимость этой величины от структуры ПХДФ [785]. Период полувыведения высокотоксичного ПХБ-169 из человека имеет величину порядка 10 лет [785].
При оральном поступлении диоксина I в организм человека более 87% его всасывается в желудочно-кишечный тракт. Накапливается он преимущественно в жировой ткани, коже и печени. Ниже приведены данные по эффективности накопления диоксина I в органах, тканях и выделениях человека в сравнении с кровью (даны коэффициенты распределения по результатам работ [786]):
жировая ткань — 300
почки — 7
кожа — 30
мышцы — 4
печень — 25
фекалии — 0,6
грудное молоко — 13
желчь — 0,5
стенки кишечника — 10
плацента (кровь плода) — 0,1
моча — 0,00005
органы с интенсивным кровообращением
(мозг, селезенка, щитовидная железа) — 10
V.1.3. Диоксиновый рецептор
Проявлению высокой токсичности диоксинов, наряду с гидрофобностью и высокой стабильностью, способствует также их высокое сродство к специфичному биологическому рецептору [60,138,143,146,149,787,788]. Такой рецептор был установлен [787]. Это цитозольный белок клеток органов-мишеней — так называемый Ah-рецептор (aromatic hydrocarbonhydroxilase). Его часто называют диоксиновым рецептором [138,149,156,787,788], хотя дискуссия по этому вопросу еще продолжается [789].
Диоксин I и родственные соединения обладают исключительно высоким сродством с Ah-рецептором. Это взаимодействие имеет большую длительность и обеспечивает высокую вероятность проявления токсических эффектов. Благодаря высокой стабильности диоксина в клетке и прочности его комплекса с биорецептором каждая его молекула многократно участвует в индукции синтеза окислительных ферментов. Вследствие этого концентрации диоксина, обеспечивающие биологическую активность, могут быть на 4 порядка меньше, чем концентрации бензпирена и аналогичных полициклических ароматических углеводородов. Связывающая способность диоксина I с Ah-рецептором печени мышей С57BL/6J составляет 84 фг/мг цитозольного белка, константа диссоциации 2,7.10 -10 M [787]. Доказана корреляция между сродством диоксинов к Ah-рецептору и их токсичностью [138,790,791].
Считается [141], что прочный комплекс диоксина с цитозольным Ah-рецептором, будучи перенесенным в ядро, участвует в активации генов, контролирующих синтез гемопротеинов, а также обычно репрессированных генов, приводя к соответствующим токсикологическим последствиям. При формулировании конкретного механизма влияния предполагается [792,793], что в ядре комплекс диоксина с Ah-рецептором активирует определенный участок ДНК (Ah-локус). В результате индуцируются микросомальные оксидазы, главным образом гидроксилазы ароматических углеводородов, и определенные формы цитохрома Р-450 (Р-448). Накопление в организме таких гемопротеидов, как цитохром Р-448 или Р-450 А1А, считается особенно опасным [95]. Он катализирует окисление различных ароматических углеводородов, арилалкиловых эфиров, ариламинов и т.д. В рамках этого механизма происходит и превращение в эпоксиды различных непредельных соединений — терпенов, микотоксинов и т.п. Таким образом, под действием диоксинов в пораженных организмах происходят несколько параллельных процессов — не только разрушение низкомолекулярных гормонов, витаминов, лекарств, метаболитов, но и биоактивация предшественников мутагенов, канцерогенов, нейротоксических ядов. Параллельно природные и синтетические соединения могут из сравнительно неопасных превращаться в высокотоксичные.
Еще один отрицательный эффект заключается в том, что индуцированный диоксином цитохром Р-450 А1А также оказывается биомишенью диоксина, образуя с ним устойчивый комплекс. Этот комплекс обеспечивает включение в клетке механизма трансформации части энергетических ресурсов в процесс одноэлектронного окисления молекулярного кислорода. Процесс сопровождается образованием свободных радикалов (О2.., OH и т.д.), накоплением пероксида водорода. Взаимодействуя с фосфолипидами клеточных мембран и субклеточных образований, они активируют пероксидное окисление липидов и другие изменения, аналогичные тем, которые возникают при ионизирующем облучении [95].
Как следствие эти изменения приводят к резкому снижению концентрации природных веществ — антимутагенных и антиканцерогенных агентов (витаминов А,В,Е,С и т.д.), простагландинов, некоторых гормонов и т.д. Происходят и другие изменения.
В целом в результате первичного процесса — индукции синтеза цитохрома Р-450 А1А — идет нарушение биохимических и физиологических процессов в самых различных клетках (гепатоцитах, энтероцитах, нервных и эмбриональных клетках, Т-лимфоцитах, клетках эпидермиса и эпителия желез крови). Процесс заканчивается лавинообразным старением и гибелью клеток.
Многообразны и объекты, а также характер возникающих поражений: наблюдаются поражения печени, кожи и центральной нервной системы, развиваются истощение организма и угнетение клеточного иммунитета, нарушается репродуктивная функция, в той или иной форме проявляются эмбрио- и фетотоксическое, терато- и канцерогенное действие.
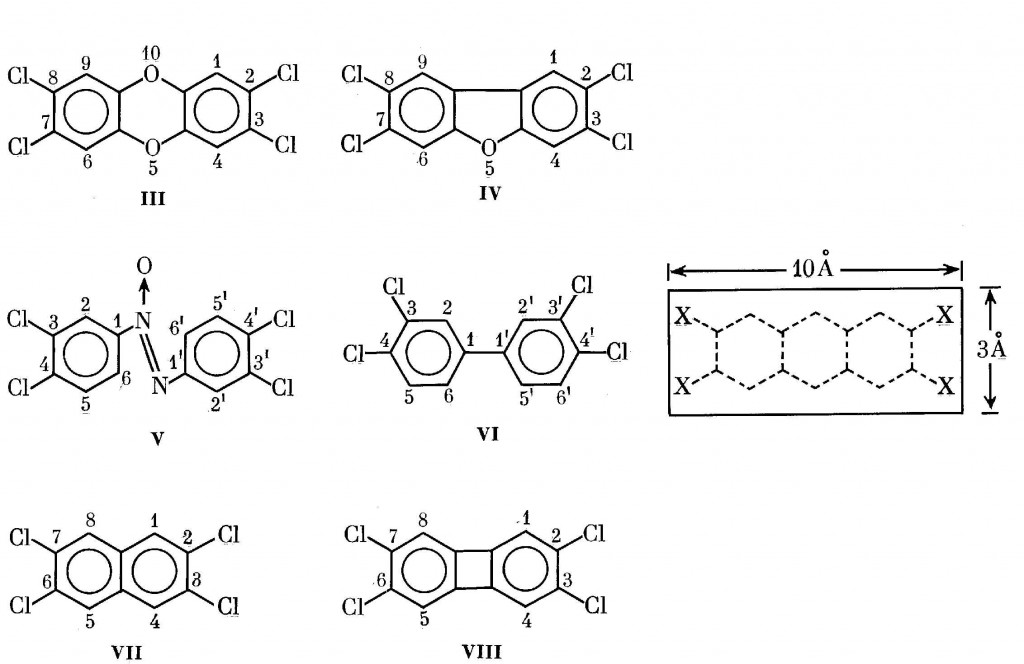
Многочисленные экспериментальные данные показали (см. разд.V.1.4), что высокая биологическая активность свойственна тем изомерам в рядах диоксинов III-VIII, которые содержат четыре атома галогена в положениях 2,3,7,8.
Наиболее отчетливо эти свойства выражены у самого I, а также у близких к нему по активности гомологов и изомеров. По мнению авторов работ [143,794], структура такого рода соединений должна укладываться в прямоугольник размером 3×10 A2, хотя другие исследователи, учитывающие ван-дер-ваальсовы радиусы атомов, рассматривают несколько иные другие размеры (6,8х13,7 А2) [795].
При обсуждении биологической активности диоксинов указывается на принципиальную роль их копланарности [796].
V.1.4. Биотрансформация. Метаболизм
Токсичность ПХДД и ПХДФ вызывается в основном действием не разрушенных живыми организмами молекулами этих ксенобиотиков. В связи с этим важно понимание путей метаболизма диоксинов, в том числе наиболее токсичных. Эта проблема рассмотрена довольно подробно [135,150,185], что вполне естественно, поскольку именно с этим связаны важнейшие вопросы устойчивости и динамики биологической активности диоксинов во времени. В частности, от направления и скорости метаболизма диоксинов зависят продолжительность их токсического действия и направление изменений при биотрансформации. Характерно, что, как правило, метаболиты наблюдаются в экспериментах in vivo [797].
Обращаясь к динамике токсичности диоксинов при их метаболизме, отметим, что одно время казалось, что процесс достаточно ясен. Для млекопитающих идентифицированы в основном два метаболита ТХДД III :
Изучение метаболизма серии ПХДД, содержащих в их скелете от одного до четырех атомов хлора, позволило выяснить, что замещаются на гидроксил и один и два атома хлора, причем в латеральном положении [798]. Это означает, что нуклеофильное замещение (гидроксилирование) должно сопровождаться детоксификацией диоксинов. И действительно было показано, что токсичность гидроксилированных метаболитов 2,3,7,8-ТХДД по крайней мере на 2 порядка ниже, чем в самом диоксине [797]. Важно также, что для метаболитов 2,3,7,8-ТХДД не характерна биоаккумуляция, и они после образования комплексов с глюкуроновой кислотой легко выводятся из организма с желчью или мочой.
Реальные процессы, однако, много сложнее. В частности, найдены признаки увеличения иммунодепрессивного действия метаболита [799].
Среди других особенностей взаимодействия 2,3,7,8-ТХДД и 2,3,7,8-ТХДФ с живыми организмами следует отметить, что скорость и направление метаболизма могут зависеть от биологических особенностей организма [800-806]. Показаны, в частности, различия в направлении и скорости биотрансформации при ее изучении у собак и крыс in vivo, хотя это различие, скорее, количественное [800-802].
Ceрьезные различия найдены в метаболизме 2,3,7,8-ТХДД в гепатоцитах морских свинок и кроликов [804].
Важно, однако, иметь в виду, что, помимо нуклеофильного замещения, диоксиновые производные могут превращаться в живых организмах и по иным механизмам, например по механизму восстановительного дехлорирования. Так, при введении в организм лабораторных животных ОХДД, многие годы считавшегося совершенно нетоксичным [143], признаки, характерные для поражения диоксином, были обнаружены, однако не сразу, а лишь через 13 недель [807]. Таким образом, за счет восстановительного дехлорирования Cl5-Cl8-производные диоксина могут преобразовываться в живых организмах в более токсичные изомеры.
Диоксин I чрезвычайно медленно метаболизируется цитохром Р-450-зависимыми монооксигеназами печени. В частности, в печени человека скорость метаболизма I составляет примерно 10-60 пмоль/ч/г ткани.
| « Назад | Оглавление | Вперед » |