VII.3. Превращения
VII.3.1. Фотолитическое дехлорирование
Как уже упоминалось в гл.II, фотолитическое дехлорирование под действием УФ-облучения осуществляется чрезвычайно эффективно [3,331]. Наиболее быстро оно происходит в органических растворителях — донорах протона [3,329,331]. В отсутствие растворителей процесс серьезно затормаживается [331]. В частности, очень медленно фотолитическое дехлорирование происходит на поверхности стекла [31,1034].
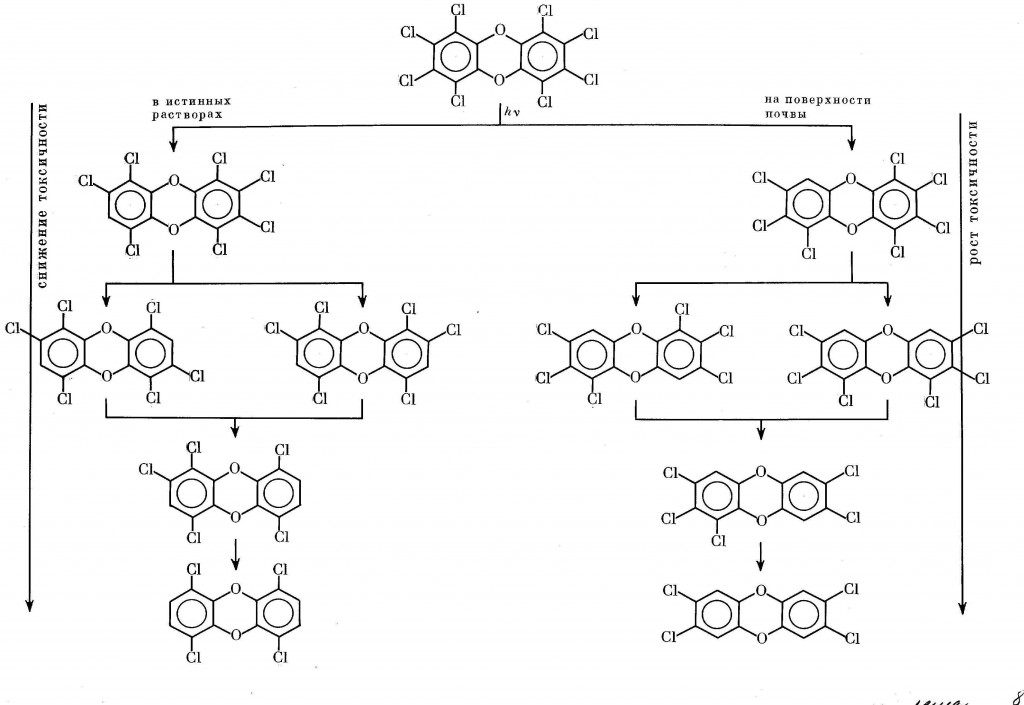
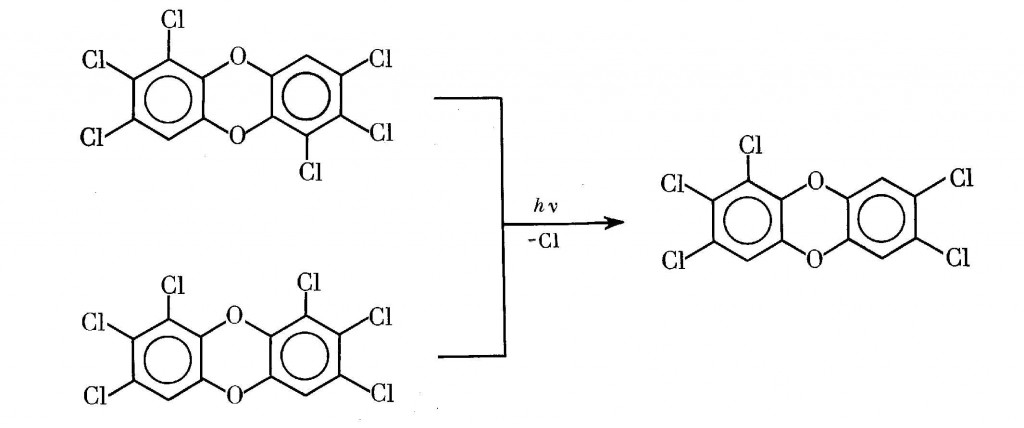
Вопрос о возможности повышения или понижения токсического фона непосредственно связан с направлением процесса фотодехлорирования. В частности, в случае сравнительно малотоксичного ОХДД оно серьезно отличается от модельных условий в растворе (см. разд.II.3). Если в растворе отрываются главным образом латеральные атомы галогена [412-414], в природе часть изомеров Cl4-, Cl5- и Cl6-дибензо-n-диоксинов образуется с отрывом пери-атомов хлора, т.е. с накоплением высокотоксичных 2,3,7,8-Cl4-изомеров [415]. Схема 12 на примере только лишь ОХДД дает представление об этом принципиальном различии.
Схема 12. Структурные вариации дехлорирования ОХДД в зависимости от условий
Аналогичный результат наблюдается при фотолизе токсичных Cl6-ДД, когда взамен возникает токсичный же Cl5-ДД [4]:
VII.3.2. Термические процессы
Известно много примеров термических превращений диоксинов и их предшественников в неживой природе, сопровождающихся возрастанием токсического фона. Показана, например, возможность превращения соли 2,4,5-Т при нагревании при 400-450°С в течение 30 мин (концентрация 2,3,7,8-ТХДД достигает при этом 1000 ppm) [454]. При сгорании эфиров 2,4,5-Т при 500-580°С также образуется диоксин 2,3,7,8-ТХДД (концентрация 0,2-3,0 ppm) [419].
При термической деструкции сравнительно малотоксичных высокохлорированных ПХДД и ПХДФ также возможно возрастание токсического фона среды, например при процессах, происходящих в МСП [129,131]. Показано также, что при пиролизе ОХДД и ОХДФ образуются ПХДД и ПХДФ с меньшим количеством атомов хлора, причем преимущественно это изомеры с фрагментом 2,3,7,8-Cl4 [569].
VII.3.3. Биологические процессы
Пути метаболизма переносчиков диоксинов, определяющиеся биологической активностью среды, в которую они попадают, могут быть различными. Они могут приводить как к разрушению, так и к дополнительному накоплению диоксинов в природе. В разд.V.1.4 были рассмотрены некоторые пути биотрансформации диоксинов, происходящей главным образом со снижением токсичности.
В работах [1035-1037] сообщено о возможности биогенного окисления хлорфенолов in vitro с образованием смеси ПХДД и ПХДФ. Показано существование энзима, способного резко увеличить скорость окисления три-, тетра- и пентахлорфенолов, в том числе 2,4,5-ТХФ. ПХДД и ПХДФ с фрагментом 2,3,7,8-Cl4 образуются в количестве 5-10% [1037].
| « Назад | Оглавление | Вперед » |