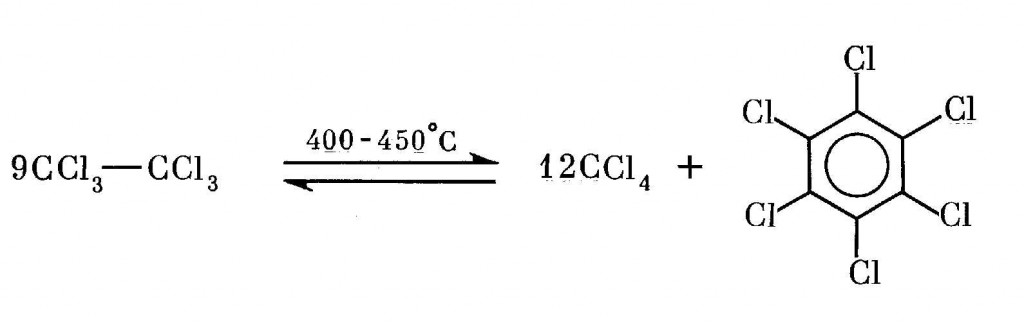ИСТОЧНИКИ ДИОКСИНОВ.
целлюлозно-бумажная - 5,9
коммунальное хозяйство - 2,7
цветная металлургия — 2,2
В отечественной промышленности электролиз осуществляется обычно одним из двух методов — с использованием твердого стального (диафрагменный метод) или же ртутного катода (ртутный метод):
2NaCl + 2H2O = Cl2 + 2NaOH + H2.
Газообразный хлор отводится из анодного пространства, анодом обычно являются углеродные или графитовые стержни [544].
Причина того, что в качестве анода использовались угольные, а в дальнейшем в основном графитовые электроды, не является чисто технической. Электроды из платины и вообще металлов платиновой группы и их сплавов имеют высокую стойкость к электролизу, однако они малоэкономичны. С другой стороны, угольные аноды малостойки в условиях электролиза и в последние десятилетия практически полностью были вытеснены в нашей практике графитовыми. Лишь с середины 70-х годов начался постепенный переход на оксидные рутениево-титановые аноды (ОРТА).
Графитовые стержни в процессе электролиза также подвергаются разрушению (их распад в зависимости от условий колеблется от 2 до 12 кг на 1 т хлора), причем продукты распада загрязняют хлор. Разрушение графита определяется в основном скоростью его окисления кислородом, выделяющимся на аноде вместе с хлором с образованием СO2 и других продуктов. Удельные расходы графитовых анодов снижают в основном за счет их импрегнирования. Увеличение стойкости графитовых анодов достигалось их пропиткой различными материалами, например льняным и тунговым маслом. В частности, пропитка графитовых электродов 15-20%-ным раствором в CCl4 приводит к сокращению их химического износа в 1,4 раза, а механического — в 2 раза. Расход графита после его импрегнирования снижается для диафрагменных электролизеров до 3,5-6,0 кг на 1 т хлора, а для ртутных — до 2-3. Однако, при импрегнировании возникает и побочный эффект — на аноде появляются продукты хлорирования масла [544]. С середины 70-х годов в нашей стране графитовые аноды импрегнировали глифталевым лаком, т.е. модернизированной талловой олифой.
Возникновение диоксинов на первой стадии промышленных хлорных технологий — получении молекулярного хлора — обсуждалось чрезвычайно редко. Однако проведенное выше рассмотрение такую возможность не исключало. В подтверждение ее реалистичности укажем на два факта.
Один из них относится к наблюдению, опубликованному в 1946 г. профессором Соринсоном [540]. Автор проанализировал данные других авторов, а также наблюдал лично заболевания хлоракне среди рабочих, занятых на разборке электролитических ванн в цехах, где хлор добывается путем электролиза хлористого натрия. Вывод был однозначен: причиной заболевания является действие «на cально-железистый и фолликулярный аппарат продуктов, возникающих в процессе электролиза на угольном аноде (хлорированные ароматические соединения и хлорированные смолистые продукты)» [540]. Автор с опорой на международную практику специально оговаривается, что «очень много»дерматозов наблюдалось именно «при осмотре рабочих, обслуживающих электрованны на предприятиях электролиза хлористого натрия». Подобное не происходило при работе с неэлектролитическим хлором. Не наблюдались профессиональные дерматозы и в электролитических производствах после замены угольных электродов на магнетитовые.
Недавно были получены данные определения диоксинов в шламах, содержавших отработанные графитовые электроды, и они не оставили места для сомнений [545,546]. Определение ПХДФ было выполнено в шведских шламах двадцатилетней давности, поскольку с 1970 г. в Швеции при получении хлора графитовые аноды не используются [546]. Результаты исследования показали, что в этих шламах до настоящего времени содержится большой набор диоксинов, главным образом группы ПХДФ. В их числе и наиболее токсичные гомологи и изомеры [545] (в ppb):
2,3,7,8-ТХДФ - 52
1,2,3,7,8-ПнХДФ — 55
2,3,4,7,8-ПнХДФ — 27
1,2,3,4,7,8-ГкХДФ — 44
1,2,3,6,7,8-ГкХДФ — 12
1,2,3,7,8,9-ГкХДФ — 1,7
1,2,3,4,6,7,8-ГпХДФ - 15
1,2,3,4,7,8,9-ГпХДФ - 14
ОХДФ — 81
Cодержание ПХДД в исследованных шламах было много меньшим (содержание ОХДД, например, составляет 0,65 ppb).
Хотя замена графитовых электродов, изготавливаемых на Новочеркасском электродном заводе, началась в нашей стране в середине 70-х годов, их используют еще очень многие заводы хлорной промышленности. Так, применяют только лишь графитовые электроды ПО «Химпром» (Уфа) и завод химических удобрений (Чапаевск). Частично используются графитовые электроды в практике ПО «Химпром» (Новочебоксарск и Усолье-Сибирское), «Капролактам» (Дзержинск), «Оргсинтез» (Новомосковск), «Каустик» (Волгоград). То же относится к предприятиям целлюлозно-бумажной промышленности: графитовые электроды применяются при производстве хлора на предприятиях Светогорска, Котласа, Амурска, Архангельска. Судьба отработанных графитовых анодов, использованных при получении хлора, различна. Графит, примененный в ртутном методе, обычно захоранивается из-за его загрязненности ртутью, а после диафрагменного метода графит используется как топливо, в частности в Чапаевске, или же бесконтрольно выбрасывается на свалки. Вопрос о загрязненности отработанных графитовых анодов диоксинами никогда не ставился.
Среди других многотоннажных продуктов хлорной химии отметим производство хлората натрия NaClO3, используемого в металлургии и при электрохимической обработке металлических изделий. Эта технология также сводится к электролизу водных растворов поваренной соли в электролизерах без диафрагмы. В качестве анода наиболее экономичным считается графит. Однако этот материал, как уже упоминалось, в процессе электролиза подвергается химическому и механическому разрушению (его расход на 1 т целевого продукта колеблется от 8-10 до 20-25 кг). Для повышения стойкости графитовые стержни пропитывают льняным маслом, хлорированным льняным маслом, хлорнафталином, талловой олифой и другими веществами [544]. Соответственно при производстве хлората натрия, как и в случае молекулярного хлора, в анодном пространстве создаются благоприятные условия для синтеза ПХДФ. Во всяком случае это непосредственно следует из отмеченного автором работы [544] «недостатка» процесса — окисления при этом графита до СО2. Микропримеси ПХДФ, возникающие в хлорате натрия, хотя пока и не найдены, неизбежно должны переходить не только в отходы, но и в производимые с использованием хлората натрия продукты — хлораты калия и магния, перхлораты, диоксид хлора и т.д.
Таким образом, необходим анализ диоксинового аспекта технологий, предусматривающих ту или иную форму превращения соединений хлора и его соединений. Причем не только неорганических производных, но и органических.
Проблема образования ПХДД и ПХДФ попутно с промышленным выпуском хлорированных алифатических и олефиновых соединений пока мало изучена. Необходимость в этом, однако, очень большая в силу того, что исторически в хлорных производствах в больших масштабах применяются технологические процессы с достаточно жесткими условиями — высокими температурами и давлениями. Помимо этого, в промышленности при различного рода «хлорных переделах» активно применяются процессы дегидрохлорирования и щелочного гидролиза, например при получении соединений с использованием хлоралифатического сырья [488].
Важность этой проблемы определяется, в частности, объемами соответствующих производств, как это следует из рассмотрения табл.7, содержащей данные о производстве некоторых хлорорганических соединений. Конкретные детали могут быть проиллюстрированы несколькими примерами.
Данные о примерных объемах производства хлорорганических соединений [370,494]
| Продукт | Ежегодное производство, тыс.т | |||||||
| США | Япония | Мировое (без СССР) | СССР | |||||
| объем | год | объем | год | объем | год | объем | год | |
| Метилхлорид | 194 | 1988 | 70* | 1981 | 400 | 1982 | 31 | 1988 |
| Метиленхлорид | 264* | 1988 | 65* | 1981 | 800 | 1983 | - | - |
| Хлороформ | 238 | 1988 | 65* | 1981 | 240 | 1975 | - | - |
| Четыреххлористый углерод | 345 | 1988 | 70* | 1981 | 1000 | 1975 | 100 | 1988 |
| Винилхлорид | 4111 | 1988 | 1992* | 1988 | 15000 | 1988 | 695 | 1988 |
| 1,2-Дихлорэтан | 6268 | 1987 | 2051 | 1987 | 19500 | 1975 | 225 | 1988 |
| Винилиденхлорид | 70-75 | 1975 | 36-40 | 1975 | 150-200 | 1975 | - | - |
| Метилхлороформ | 477* | 1989 | 88 | 1976 | 480 | 1975 | 3 | 1991 |
| Трихлорэтилен | 110 | 1989 | 80 | 1989 | 1000 | 1975 | 105 | 1988 |
| Тетрахлорэтилен | 225 | 1988 | 50,7 | 1976 | 1100 | 1980 | - | - |
| Эпихлоргидрин | 234 | 1975 | 55 | 1975 | 470* | 1978 | 51 | 1988 |
| Хлорпарафины | 90,8 | 1987 | - | - | 150 | 1976 | 43 | 1988 |
| Этилхлорид | 74,3 | 1987 | - | - | - | - | 34 | 1988 |
| * Мощность | ||||||||
Так, три- и тетрахлорэтилены являются массовой продукцией хлорорганической промышленности [370,493]. Трихлорэтилен, выпускаемый в бывшем СССР (ГОСТ 5705-70 и 9976-70), получается методом жидкофазного щелочного дегидрохлорирования симметричного 1,1,2,2-тетрахлорэтана. Изготовители — ПО «Химпром» (Уфа, Усолье-Сибирское и Волгоград), ПО «Каустик» (Стерлитамак), ПО «Капролактам» (Дзержинск). Продукт расходуется главным образом на обезжиривание металлических поверхностей в радио- и электронной промышленности. С точки зрения технологии чрезвычайно важно то, что побочным продуктом производства трихлорэтилена является дихлорацетилен, который легко тримеризуется в ГХБ [370,493] и чьи диоксиновые примеси уже обсуждались. В зарубежных образцах тетрахлорэтилена также найдены примеси высокохлорированных ПХДД и ПХДФ [53,489]. Отгонка трихлорэтилена-сырца и его ректификация проводятся на отечественных заводах при 90-120°С [492], вследствие чего еще большая часть примесей ПХДД и ПХДФ неизбежно должна сосредоточиваться в кубовой жидкости, направляемой не только в отходы, но и на изготовление моющего средства «Ритм».
Весь эпихлоргидрин (ГОСТ 12844-74) получается в бывшем СССР из cмеси дихлоргидринов глицерина методом высокотемпературного (95-100°С) дегидрохлорирования в щелочной среде. Производители — ПО «Каустик» (Стерлитамак), ПО «Оргсинтез»(Сумгаит) и ПО «Химпром» (Зима). Щелочной гидролиз эпихлоргидрина в глицерин осуществляется при высоких температурах и давлениях, причем герметичность процесса не обеспечивается [547]. Таким образом, в течение нескольких «химических переделов» рабочие контактируют с высокотоксичными микропримесями, а последние в свою очередь неизбежно накапливаются в конечных продуктах — эпихлоргидрине, глицерине и их отходах.
Проблема попутного образования диоксинов, однако, пока не обсуждается [370]. Большая часть производимого в мире эпихлоргидрина расходуется на получение синтетического глицерина, а также производство эпоксидных смол и ряда ионообменных смол [370,493], и в зарубежном 99%-ном эпихлоргидрине недавно были найдены особенно большие количества ПХДД и ПХДФ, содержащих от Сl6 до Сl8 [53,489].
Весь отечественный винилиденхлорид также производится методом жидкофазного щелочного дегидрохлорирования 1,1,2-трихлорэтана при 100°С (ОСТ 6-01-28-76). Побочным продуктом при этом оказывается монохлорацетилен, легко тримеризующийся на свету в 1,3,5-ТХБ [370,493]. Микропримеси диоксинов, возможные при образовании самого винилиденхлорида, естественно, переходят в метилхлороформ, получающийся его гидрохлорированием. Производители винилиденхлорида — завод химических удобрений, Чапаевск (4-5 тыс. т), и заводы Волгограда. Потребители метилхлороформа — предприятия радиоэлектронной и авиакосмической отраслей промышленности, использующие его для обезжиривания наиболее ответственных электронных устройств.
Производство винилхлорида, наиболее массового хлорорганического продукта отечественной промышленности (ОСТ 6-01-23-75), получаемого на ПО «Каустик» (Стерлитамак), ПО «Хлорвинил» (Калуш), Саянском ПО «Химпром» (Зима) и т.д., экологически неоптимально. Его получают из 1,2-дихлорэтана газофазным дегидрохлорированием при высоких температурах (400-550°С) и давлениях (20-30 атм) в каталитических условиях. Степень превращения дихлорэтана при этом не более 60%, а количество неутилизируемых отходов на 1 млн т продукции составляет примерно 50 тыс. т, которые уничтожаются в печи сжигания [370,493]. Проблема возникновения диоксинов в процессе выпуска винилхлорида еще не поставлена [370], однако в зарубежных образцах 1,2-дихлорэтана, предназначенного для дальнейшего синтеза, были найдены высокохлорированные ПХДД и ПХДФ [53,489].
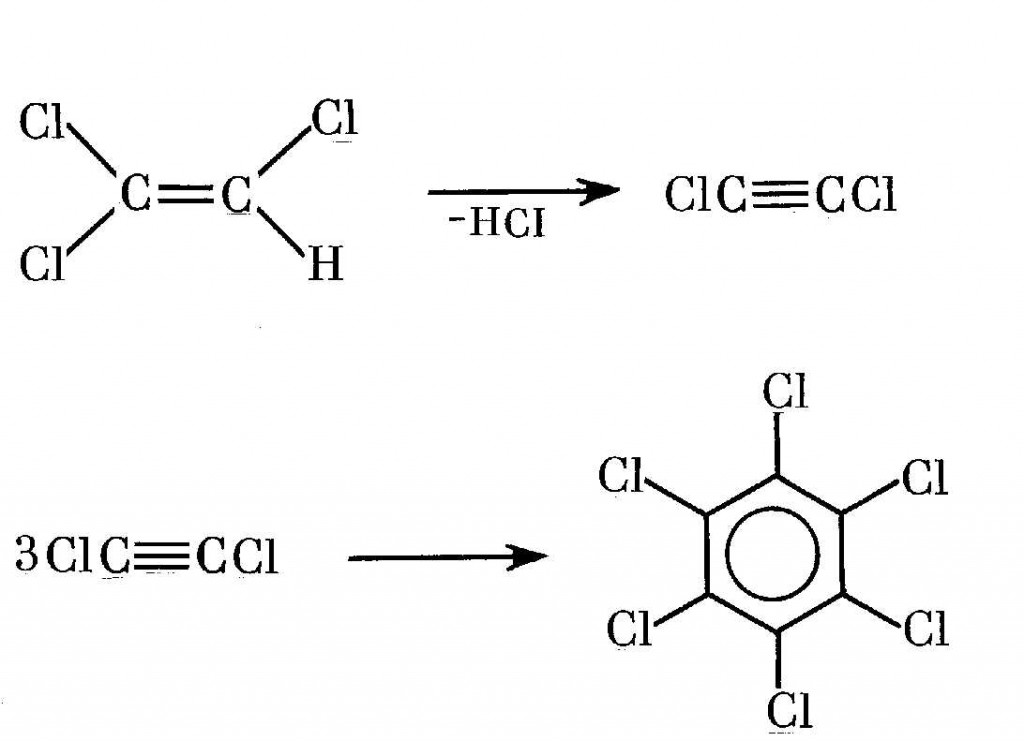
Гексахлорбутадиен является одним из компонентов диэлектрических и гидравлических жидкостей [370]. Производится на опытном заводе ВНИТИГ (Уфа) методом исчерпывающего высокотемпературного (450-500°С) газофазного хлорирования углеводородной фракции С4, содержащей непредельные углеводороды (МРТУ 6-01-267-68). Выход целевого продукта — не более 77% [370,493,548]. Вопрос об образовании диоксинов в этом процессе пока не обсуждался [370]. В зарубежных промышленных образцах гексахлорбутадиена найден ОХДФ в концентрации 0,4 ppb [53,489].
Гексахлорэтан выпускается в бывшем СССР c конца 40-х годов в Чапаевске на заводе химических удобрений (ГОСТ 9991-66). Для синтеза используется метод каталитического парофазного хлорирования полихлорэтанов, при котором температура реакции поддерживается на уровне 270-290°С (экологически более безопасно жидкофазное хлорирование тетрахлорэтилена при 90-100°С). Хлор подается c 20-30%-ным избытком против стехиометрического. Отработанный активированный уголь (10 кг/т) вывозится в отвал. Примеси — пентахлорэтан, тетрахлорэтилен [370,493,549]. Анализ на диоксины ни на одной из стадий процесса производства никогда не производился, так же как не анализировались ни товарные продукты, ни отходы производства.
Таким образом, образование диоксинов в отечественных технологиях выпуска массовой хлорорганической продукции неизбежно. Хотя соответствующие аналитические данные пока отсутствуют, их получение — лишь вопрос времени. Результаты выполненных недавно зарубежных измерений [53,489,550], относящихся к более совершенным технологиям, подтверждают эти предположения.
Естественное предположение, которое высказывается в связи с имеющимися аналитическими данными о наличии диоксиновых веществ в хлорорганических соединениях — это гипотеза об их возникновении из хлорированных ароматических соединений [485]. Последние образуются не только в качестве целевого продукта химических технологий (см. выше). Они возникают и в виде попутных продуктов в процессе различных превращений хлорированных алифатических и олефиновых соединений.
В частности, это происходит в упоминавшемся производстве трихлорэтилена:
Появление хлорбензолов обсуждается [53] в связи с равновесиями, устанавливающимися в пиролитических условиях для таких хлорированных углеводородов, как CCl4, C2Cl4, C2Cl6, C4Cl6 и C6Cl6:
Авторы работы [53] оговариваются, что пиролиз не представлен в промышленном производстве хлоралифатических соединений, однако как побочные процессы подобного рода неизбежны в различных производствах. В действительности высокотемпературные пиролитические условия не так уж редки. В частности, они возникают при обсуждавшемся выше производстве винилхлорида, получаемого реакцией дегидрохлорирования при 400-550°С. То же самое относится к производству гексахлорбутадиена. Соответственно неизбежны процессы попутного образования хлорбензолов.
Источником кислорода во всех случаях служат или атмосферный воздух или/и гидроксид натрия, являющийся элементом многих технологических процессов. Более подробно этот вопрос будет рассмотрен в разд.IV.2.1.
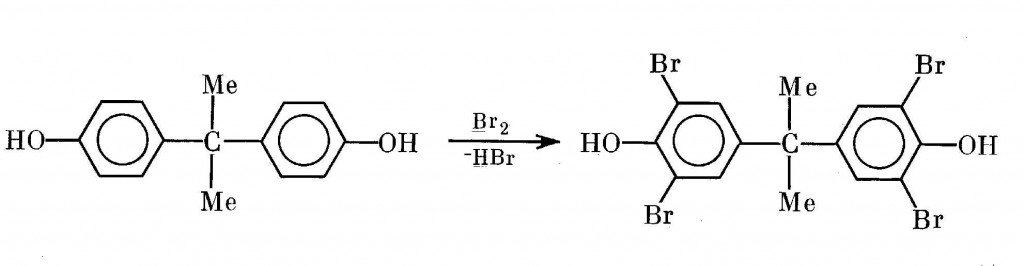
Промышленное производство броморганических веществ, широко используемых в качестве антипиренов, также может оказаться источником соответствующих бромдиоксинов V и VI. Тетрабромдифенилолпропан, применяемый при производстве гетинакса пониженной горючести, необходимого при выпуске телевизоров, получают прямым бромированием дифенилолпропана в органическом растворителе жидким бромом [53,370,551]:
В бывшем СССР производство этого продукта было налажено в 1984 г. на Небит-Дагском иодном заводе [551]. Данные об измерениях в нем ПБДФ не известны [490].
Между тем зарубежные данные на эту тему уже имеются [53,290]. Как оказалось, в коммерческом тетрабромдифенилолпропане в виде микропримесей может присутствовать большая серия диоксинов VI — ПнБДФ, ГкБДФ, ГпБДФ и ОБДФ. Последние два оказались преобладающими.
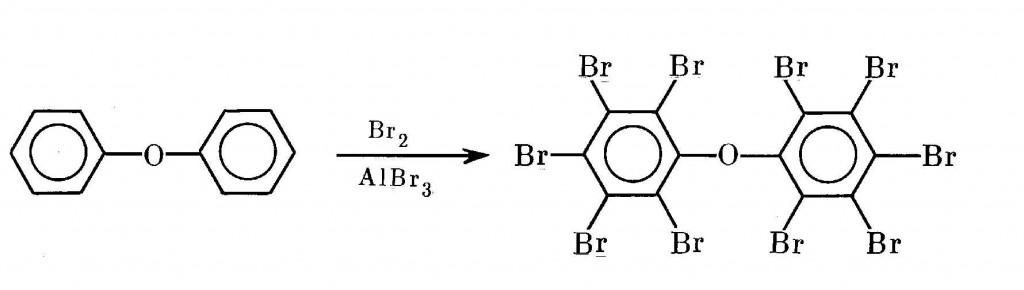
Огнестойкость пластмассам придает и декабромдифенилоксид, объемы выпуска которого в середине 70-х годов исчислялись миллионами литров. Получают этот антипирен каталитическим бромированием дифенилового эфира избытком брома при температурах от 35 до 60°С [53,370]:
В бывшем CCCР начало производства этого антипирена было намечено в 1989-1990 гг. на Славгородском ПО «Алтайхимпром» (ТУ 6-22-43-79) [552], и его опытная партия действительно была выпущена [553]. Это вещество также входит в состав комплексного антипирена «Бромант Д-15-42″ (ТУ 6-22-11-80-85), выпускаемого Крымским ПНО «Иодбром» [552].
Проблема, однако, оказалась очень сложной. Известно, что волокна полимеров, к которым для огнестойкости примешивают декабромдифенилоксид, получаются экструзией через фильеры при нагревании от 200 до 300°С. Это относится, в частности, к полибутилентерефталату. Оказалось, что в этих технологически неизбежных температурных условиях декабромдифенилоксид эффективно превращается в смесь ПБДФ. Этот результат был получен в опытах как с самим антипиреном, так и с реальной смесью полимера с антипиреном [554]. Аналогичные данные получены при изучении экструзии октабромированного дифенилового эфира с другими полимерными смолами [555].
Еще один источник диоксинов — это промышленное производство неорганических хлоридов. Изучение коммерческих хлоридов металлов, выполненное в последние годы [489], показало, что некоторые содержат большие количества высокохлорированных ПХДФ (в ppb):
Fe(III) — ГпХДФ (12) и ОХДФ (42);
Al(III) — ГпХДФ (0,1) и ОХДФ (34).
В несколько меньших количествах ПХДФ найдены также в хлоридах меди Cu(I) и Cu(II). Данные работы [489] об обнаружении различных ПХДФ в коммерческом FeCl3 недавно были подтверждены [556].
Микропримеси ПХДФ возникают в процессе синтеза, осуществляющегося путем высокотемпературного хлорирования металла, к которому обычно добавляют металлолом (температура процесса 650°С в производстве FeCl3 и 750-800°С в производстве АlCl3). Источником ПХДФ являются органические вещества, неизбежно сопутствующие вторичному металлу — смазочные масла, остатки охлаждающей жидкости на стружке и т.д. [489]. В бывшем СССР FeCl3.6H2O производится на Уральском ПО «Галоген» (Пермь), Сакском химическом заводе и на Крымском ПО «Химпром» [552], однако данные об определении в них примесей ПХДФ не известны.
| « Назад | Оглавление | Вперед » |